La entomología forense surge como apoyo técnico-científico a la investigación criminalística, aportando información sobre la data de muerte. Un método comúnmente utilizado es la sucesión de la entomofauna cadavérica sobre el cuerpo, sin embargo, la mayoría de los estudios se realiza empleando cadáveres de animales. Debido a esto, el presente estudio pretende utilizar como biomodelo vísceras de res, para determinar la secuencia de sucesión de las especies de importancia forense en el Estado Carabobo. Se emplearon pulmón e hígado, y la entomofauna fue colectada e identificada durante ocho días. Se obtuvieron 127 individuos adultos del Orden Diptera, pertenecientes a las Familias: Calliphoridae (67,9%), Muscidae (23,1%), Piophilidae (5,3%) y Sarcophagidae (3,7%); en Coleoptera se obtuvieron 7 ejemplares adultos de Dermestidae y Cleridae. Las especies reportadas fueron Chrysomya megacephala, Lucilia cuprina, Chrysomya albiceps y Cochliomyia macellaria, para Calliphoridae; Dermestes maculatus y Necrobia rufipes en Dermestidae y Cleridae, respectivamente. La mayor riqueza y abundancia de insectos se encontró en los primeros días de descomposición, seguido de la aparición de larvas que degradan de forma progresiva los tejidos y la presencia de coleópteros. El patrón de sucesión coincide con otros estudios realizados en los Estados Aragua y Carabobo, los cuales contemplaron el uso de cadáveres de conejos y roedores, respectivamente. La implementación de este biomodelo permitirá el desarrollo de protocolos de muestreo con el fin de generar una base de datos que relacione las fases de descomposición con listados de especies de importancia forense.
INTRODUCCIÓN
El rol y la importancia del entomólogo forense en la investigación médico-legal, mediante el análisis y estudio científico de las evidencias entomológicas, permite datar el intervalo postmortem mínimo (IPM) a través de la entomofauna o insectos de interés forense en cuerpos sin vida (1), específicamente cuando el cuerpo se encuentra en un estado avanzado de descomposición. Incluso el Ministerio Público en su Manual Único de Procedimientos en Materia de Cadena de Custodia de Evidencias Físicas, plantea que "se deberá verificar la data de muerte, mediante la evaluación de los fenómenos cadavéricos, tempranos y tardíos, así como desde el punto de vista de Entomología en caso de que existiera" (2).
Para ello, se han establecidos tres métodos: 1) Estimación de la edad de la larva y su tasa de desarrollo mediante el uso de curvas de crecimientos estandarizadas para longitud y peso; 2) la acumulación total de grados horas, que reflejan el tiempo que ha tardado el insecto en llegar a la fase de desarrollo en que se ha colectado en el lugar del hallazgo (1) y 3) la sucesión de la entomofauna en la descomposición del cadáver (3). Esta última se debe a que existe una sucesión de la entomofauna que sigue unos patrones predecibles facilitando la estimación del IPM (4).
Diversos autores han resaltado la importancia que tiene la entomología forense trascurridas las 72 horas después de la muerte, siendo el mejor método y en muchos casos el único para establecer el tiempo de muerte (5,6). En tal sentido, la sucesión entomológica se utiliza generalmente en las fases más avanzadas de la descomposición del cadáver y se basa en la composición y grado de crecimiento de la comunidad de insectos encontrados sobre el cuerpo, en sus alrededores y dentro del mismo (3). Posteriormente esta sucesión se compara con patrones conocidos de sucesión de la entomofauna para la zona geográfica y las condiciones más cercanas de parámetros ambientales del sitio del suceso. Generalmente se expresa en matrices de ocurrencia y/o modelos de regresión (3,7).
En Venezuela, se han realizado pocos estudios haciendo énfasis en la sucesión de la entomofauna, dentro de los biomodelos más utilizados se encuentran las ratas Sprague- Dawley de laboratorio (8), ratas variedad albina [Rattus norvegicus (Berkenhout, 1769)] (9,10), conejos blancos raza Nueva Zelanda [Oryctolagus cuniculus (Linnaeus, 1758)] (9), gato doméstico [Felis silvestris Schreber, 1775] (5), otros trabajos han reportado el uso del cerdo doméstico [Sus scrofa Linnaeus, 1758] y restos de res, pollo y pescado en descomposición (1). Sin embargo, aún no se han realizado investigaciones empleando únicamente restos de vísceras en descomposición. Por lo anteriormente expuesto, el presente estudio tiene por finalidad conocer la composición de especies de insectos asociados a vísceras de res, con el fin de relacionar las distintas fases de descomposición con la entomofauna cadavérica.
MATERIALES Y MÉTODOS
Localización del área de estudio. El estudio se realizó en abril de 2013, en un espacio físico abierto correspondiente a la azotea de un edificio a una altura de 12 metros (10º13´78´´ Latitud Norte y 68º00´32´´ Latitud Oeste), situado en la avenida Bolívar de Valencia-Estado Carabobo.
Modelo de estudio. Se utilizó como biomodelo vísceras de res [Bos taurus (Linnaeus, 1758)], correspondientes al hígado y los dos pulmones. Todas las vísceras se colocaron dentro de una bolsa plástica de color blanco abierta y restos de papel periódico en su interior.
Estado de descomposición de las vísceras. Con base en los cambios físicos de las vísceras, se describió el
color, textura y temperatura de las mismas. Realizando la comparación con los estados de descomposición (cromático, enfisematoso, colicuativo o licuefacción y reducción esquelética).
Tiempo de muestreo. El muestro se realizó durante ocho días, desde el 23 al 30 de abril 2013. Los insectos tanto adultos como inmaduros (huevos, larvas y pupas) se colectaron una vez al día (12:00 pm). Durante cada colecta de las muestras, se tomaron los parámetros ambientales de temperatura y humedad relativa. Durante el estudio la temperatura promedio fue de 32,52 ºC (26,4 – 40,5 ºC) y humedad relativa promedio 54,50 % (31,4 – 77,6 %).
Colecta de individuos. Los insectos adultos (dípteros) que se encontraban volando sobre las vísceras fueron colectados con ayuda de una red entomológica, luego se sacrificaron en frascos de vidrio con etanol al 70%. La colecta de inmaduros (dípteros) se hizo directamente de las vísceras con ayuda de una pinza entomológica y se introdujeron en frascos plásticos con sustrato alimenticio tipo hígado de res, cubriendo el frasco con una gasa.
Los coleópteros adultos fueron colectados directamente de las vísceras con ayuda de pinzas entomológicas y sacrificados en frascos de vidrio con etanol al 70%. Las muestras fueron trasladadas al Laboratorio de Biodiversidad Animal del Departamento de Biología, Facultad de Ciencias y Tecnología-Universidad de Carabobo. En el laboratorio las larvas fueron sacrificadas en agua hirviendo para fijar el tegumento, y se almacenaron en alcohol al 70%.
Identificación de la entomofauna. Los insectos tanto larvas como adultos fueron identificados con ayuda de una lupa estereoscópica OPTIKA modelo SZP-10, con oculares 10x y aumento máximo 80x y el uso de claves taxonómicas (11- 14). Cuando se hizo necesario, las larvas fueron aclaradas en hidróxido de potasio (KOH), con el fin de estudiar la morfología del esqueleto cefalofaríngeo (11-12).
Se construyó una gráfica de abundancia durante la sucesión, con las principales especies de interés forense de los Ordenes Diptera y Coleoptera, para interpretar su comportamiento a lo largo de los 8 días de muestreo. La sucesión obtenida se comparó con los trabajos previos realizados en países de América Latina y en especial los reportes para el Estado Carabobo, como una herramienta en el estudio de la sucesión de la entomofauna con fines forenses y la determinación del IPM.
RESULTADOS
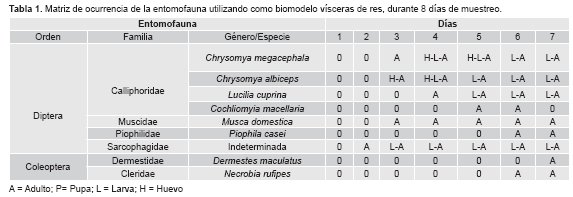
Durante los ocho días de muestreo se colectaron un total de 127 individuos adultos del Orden Diptera, pertenecientes a las Familias: Calliphoridae (67,9%), Muscidae (23,1%), Piophilidae (5,3%) y Sarcophagidae (3,7%). Dentro de la Familia Calliphoridae las especies reportadas fueron: Chrysomya megacephala (Fabricius, 1794) (72,2%), Lucilia cuprina (Wiedemann, 1830) (15,4%), Chrysomya albiceps (Wiedemann, 1819) (10,6%) y Cochliomyia macellaria (Fabricius, 1775) (1,8%). Para el Orden Coleoptera se reportaron cinco individuos adultos de la especie Dermestes maculatus (De Geer, 1774) y tres individuos adultos de Necrobia rufipes (Fabricius, 1781). La sucesión de la entomofauna en los diferentes estados de descomposición a los largo de los ocho días de muestreo, se presentan en la Tabla 1.
Fenómenos cadavéricos y entomofauna asociada.
Estado fresco. Dos días de duración, restos de vísceras de res contenidas en una bolsa plástica de color blanco, cuya capacidad es de 30 Kg. Las vísceras corresponden a un hígado y dos pulmones. Al primer día se constató cierto enfriamiento de las vísceras, ausencia de rigidez (Fig. 1 y 2: A). Pulmón: órgano par en estado fresco, textura esponjosa de consistencia blanda, color característico (rosa-grisáceo). No se observa presencia de insectos al primer día (lluvioso). Hígado: órgano impar en estado fresco, textura lisa de consistencia homogénea, color característico (rojo oscuro). Al segundo día (soleado) se observan cambios de coloración de las vísceras (palidez), debido a la deshidratación cadavérica (Fig. 1 y 2: B). Al segundo día se observa la presencia de moscas de la Familia Sarcophagidae.
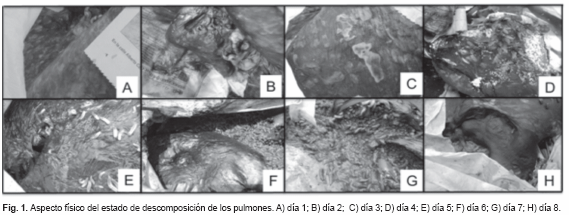
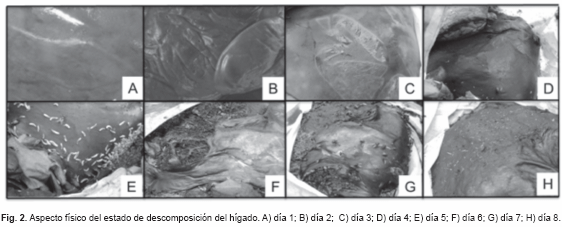
Período cromático. Un día de duración (soleado). Pulmón: textura esponjosa de consistencia blanda, la cubierta externa de consistencia acartonada, cambio de coloración (rosa-grisáceo, con flictenas en la superficie).
Hígado: textura lisa de consistencia flácida y movible, cambio de coloración (vetas verdes con morado) presente. Se observan puestas de masa de huevos en las vísceras, especies de la Familia Calliphoridae, Muscidae y Sarcophagidae alimentándose de los líquidos biológicos emanados de las vísceras (Fig. 1 y 2: C).
Período enfisematoso. Un día de duración (lluvioso), vísceras poco diferenciadas. Pulmón: textura esponjosa de consistencia blanda, la cubierta externa de consistencia acartonada. Cambio de coloración (grisáceo-morado con vetas negras), no se observa el aspecto hinchado característico, liberación de gases. Hígado: textura lisa de consistencia flácida y movible, cubierta externa acartonada. Cambio de coloración (marrón negruzco), aspecto hinchado y liberación de gases (Fig. 1 y 2: D). Presencia de abundantes moscas adultas, masa de huevos y larvas de primer y segundo instar, se reportan la presencia de cinco especies.
Período colicuativo. Tres días de duración (lluvioso - soleado - soleado). Vísceras indiferenciadas, con presencia de putrílago y liberación de gases. Coloración marrón-negruzca (Fig. 1 y 2: E-G). En este período se observó un incremento en la masa larva activa que se alimentan de los tejidos y otras migran para pupar, donde abundaba la presencia de las larvas de la especie Chrysomya albiceps. Inicia la aparición de otras especies y la presencia de coleópteros necrófagos (D. maculatus) y necrófilos (N. rufipes).
Período de reducción. Ya al octavo día de muestreo se inicia con este período, caracterizándose por la reducción del tejido de las vísceras (Fig. 1 y 2: H), aspecto de cuero endurecido y color negruzco. Aparecen las primeras pupas, incrementa la presencia de coleópteros y la aparición de pequeñas larvas de la especie Piophila casei (Linnaeus, 1758).
DISCUSIÓN
Tradicionalmente, en la estimación del IPM basado en la sucesión de insectos se utiliza una matriz de ocurrencia (7). Ésta refleja la presencia o ausencia de determinada especie asociada a un intervalo de tiempo durante la descomposición (3). La mayoría de las matrices de ocurrencia se realizan con base a cadáveres de Sus scrofa domestica, debido a la características de similitud en el proceso de putrefacción, así como el tamaño, con respecto al ser humano (3,5). El uso de vísceras permite evaluar la sucesión de la entomofauna cadavérica y los fenómenos cadavéricos que ocurren de forma progresiva, lo cual trae como ventaja conocer cómo es la descomposición de los diferentes órganos y a su vez cómo los insectos destruyen los mismos.
Sin embargo, una de las condiciones más importantes para la correcta interpretación de los datos, es la localización geográfica del cadáver, dado a que afecta la sucesión de la entomofauna y la tasa de descomposición del cuerpo. Un sitio del suceso a 2 ºC, no favorece la colonización de los insectos, así como también, detiene el proceso de putrefacción del cadáver, convirtiéndose en un proceso conservador del mismo. Por otro lado, al comparar las sucesiones que se desarrollan en los distintos tipos de ambientes, se concluye que la abundancia de las especies de insectos se relaciona mucho más con el tipo de ambiente que con los estados de descomposición del cuerpo (1). Se confirma que, un clima poco variable, hace que exista un mayor control sobre la sucesión de los insectos, ya que se produce solapamiento de especies, rápido desarrollo de las larvas y una tasa acelerada de deterioro de los tejidos (5).
Sobre las vísceras, en los primeros días de descomposición, se aprecia la alta proporción de especies y abundancia de individuos, particularmente necrófagos de la Familia Calliphoridae, que luego de completar su fase larvaria migran al suelo para pupar, dejando las mismas para que otros organismos como el D. maculatus puedan aprovechar los tejidos secos, como ha sido reportado para el estado Carabobo (8). Hay presencia abundante de las moscas adultas correspondiendo a la especie C. megacephala, que ha sido reportada ampliamente para la región (1). Mientras que en los estados inmaduros, la especie C. albiceps fue la más abundante; esto se debe a que es altamente competitiva con otras especies, logrando desplazar y colonizar totalmente el cadáver, incluso observando larvas de III instar depredando otras larvas (9,15).
Es por ello que en las zonas geográficas donde C. albiceps está presente se utiliza esta especie como principal bioindicador del IPM (15). Otras especies como indicadores de una etapa avanzada de descomposición son la presencia de P. casei y coleópteros como D. maculatus, que indican una etapa avanzada en la descomposición. Aunque los sarcofágidos fueron igualmente reportados, diversos autores plantean que la poca disponibilidad de información taxonómica sobre esta Familia, dificulta su utilización como bioindicadores forense (16). La mira de la entomología forense, se ha enfocado en utilizar Familias y especies poco reportadas e identificadas como Sarcophagidae, Piophilidae, Phoridae, entre otras; para obtener mayor discriminación a la hora de utilizar la sucesión de la entomofauna como herramienta para establecer data de muerte.
El estado de descomposición avanzado (enfisematoso, colicuativo y reducción de restos) duró más tiempo que el período fresco y cromático; esto se debe a que no existen factores ambientales que detuvieran la rápida descomposición de las vísceras a putrílago (17), el cual se ve favorecido por la presencia de larvas de dípteros que se alimentan del tejido, y fluidos de las vísceras que son desgarrados por las piezas bucales de las larvas (1). Se observa el mayor número de especies del Orden Diptera en estado larval, donde se mostró una coexistencia entre las diversas especies presentes en el biomodelo, como se reporta en trabajos previos (17,18).
Los resultados obtenidos de esta investigación coinciden con otros trabajos realizados en el Estado Carabobo, por ello ¿La sucesión de la entomofauna cadavérica representa en un país tropical, variaciones marcadas en la composición cualitativa y cuantitativa de las especies presentes, para que se considere un método confiable como indicador del IPM? Un trabajo realizado en Costa Rica (16) planteó esa interrogante, enmarcada en la poca variación observada de sus experimentos, acotando que el análisis realizado permitió orientar acerca del período de muerte, pero la imposibilidad de darle connotación cuantitativa a las observaciones dificultó el establecimiento de conclusiones definitivas. Sin embargo, la información derivada de las mismas da una idea de la temporalidad y de la localización geográfica que pueden ser claves para la interpretación de los análisis forenses (16).
En conclusión, el uso de insectos como evidencia para la datación del IPM, es una herramienta útil, considerando una serie de factores como son: los parámetros ambientales y la descripción geográfica del sitio del suceso, la colecta e identificación correcta de todas las especies presentes sobre el cuerpo y la evaluación de los fenómenos cadavéricos observables. Conocer las especies de insectos presentes en una zona geográfica determinada mediante estudios experimentales, aportaría modelos predictivos o bases de datos estadísticamente robustas que establezcan la data en intervalo de días de la muerte de un individuo, estableciéndose la necesidad de reducir ese intervalo en horas. Por ello, la elección del método para la datación dependerá de la información obtenida del sitio del suceso y de las evidencias entomológicas colectadas. Considerándose que un método específico no garantiza la precisión y exactitud del IPM, el entomólogo forense establece una data mínima de muerte de un individuo basado en el desarrollo biológico del insecto o mediante su presencia o ausencia en la comunidad de insectos presente sobre el cuerpo. La aplicación de la entomología forense en Venezuela, requiere la formación de investigadores y funcionarios que aborden de forma integral los casos forenses que involucren insectos y otros artrópodos como evidencia, con el objetivo de dar cumplimiento a la labor de establecer la data de muerte de un individuo con fines forenses.
REFERENCIAS
1. Nuñez, J. Entomología forense en Venezuela. 1era edición. Caracas, Editorial Livrosca; 2012. p. 273. [ Links ]
2. Ministerio Público. Manual Único de Procedimientos en Materia de Cadena de Custodia de Evidencias Físicas. Caracas 2012; p. 309.
3. Camacho, G. Sucesión de la entomofauna cadavérica y ciclo vital de Calliphora vicina (Diptera: Calliphoridae) como primera especie colonizadora, utilizando cerdo blanco (Sus scrofa) en Bogotá. Rev Colomb Entomol 2005; 31:189-197. [ Links ]
4. Smith, K. A Manual of forensic entomology. New York, The Trustees of the British Museum (Natural History) and Cornell University Press; 1986. p. 205. [ Links ]
5. Mavárez M, Espina A, Barrios F, Fereira J. La Entomologia forense y el neotrópico. Cuad Med Forense 2005; 11:22-33. [ Links ]
6. Gennard, D. Forensic entomology. An introduction. John Wiley & Sons Ltd, The Atrium, Southern Gate, Chichester, England 2007; 170 p.
7. Magaña, C. La entomología forense y su aplicación a la medicina legal. Data de la muerte. Aracnet 7 –Bol. S.E.A. 2001; 28:49-57.
8. Liria J. Insectos de importancia forense en cadáveres de ratas, Carabobo-Venezuela. Rev Perú Med Exp Salud Pública 2006; 23:33-38. [ Links ]
9. Magaña C, Andara C, Contreras M, Coronado A, Guerrero E, Hernandez D, Herrera M, Jiménez M, Liendo C, Limongi J, Liria J, Mavárez M, Oviedo M, Piñango J, Rodríguez I, Soto A, Sandoval M, Sánchez J, Seijas N, Tiape Z, Vásquez Y. Estudio preliminar de la fauna de insectos asociada a cadáveres en Maracay, Venezuela. Entomotropica 2006; 20:53-59. [ Links ]
10. Velásquez Y. A checklist of arthropods associated with rat carrion in a montane locality of northern Venezuela. Forensic Sci Int 2008; 174:67-69. [ Links ]
11. Florez E, Wolff M. Descripción y clave de los estadios inmaduros de las principales especies de Calliphoridae (Diptera) de importancia forense en Colombia. Neotropical Entomol 2009; 38:418-429. [ Links ]
12. Velásquez Y, Magaña C, Martinez A, Rojo S. Diptera of forensic importance in the Iberian Peninsula: larval identification key. Med Vet Entomol 2010; 24:1-16. [ Links ]
13. Amat E, Vélez M, Wolff M. Clave ilustrada para la identificación de los géneros y las especies de califóridos (Diptera: Calliphoridae) de Colombia. Caldasia 2008; 30:231-244. [ Links ]
14. Carvalho C, Mello C. Key to the adults of the most common forensic species of Diptera in South America. Res Bras Entomol 2008; 52:390-406. [ Links ]
15. Ortloff A, Jara A, Albornoz S, Silva R, Riquelme M, Peña P. Primer reporte en Chile de Chrysomya albiceps (Diptera: Calliphoridae) en evidencia entomológica forense. Arch Med Vet 2013; 45:83-89. [ Links ]
16. Calderón O, Troyo A, Solano M. Sucesión de larvas de muscoideos durante la degradación cadavérica en un bosque premontano húmedo tropical. Rev Biomed 2005; 16:79-85. [ Links ]
17. Beltrán C, Villa, F. Sucesión de insectos en cadáveres de ratas Wistar (Muridae: Rattus norvegicus) (Berkenhout, 1769) en bosque húmedo premontano (Ibagué-Colombia). Rev Tumbaga 2011; 6:93-105. [ Links ]
18. Martínez H, Jaramillo F, Escoto J, Rodríguez M, Posadas F, Medina I. Estudio comparativo preliminar de la sucesión de insectos necrófagos en Sus scrofa intoxicado con paratión metílico, en tres períodos estacionales. Rev Mex Cien Farm 2009; 40:5-10. [ Links ]
Fuente: NUNEZ RODRIGUEZ, José e LIRIA SALAZAR, Jonathan. Sucesión de la entomofauna cadavérica a partir de un biomodelo con vísceras de res. Salus [online]. 2014, vol.18, n.2 [citado 2016-05-10], pp. 35-39 . Disponível em: <http://www.scielo.org.ve/scielo.php?script=sci_arttext&pid=S1316-71382014000200007&lng=pt&nrm=iso>. ISSN 1316-7138.